シアル酸の科学
シアル酸 ―現代新薬の創製まで―
- 第2章 シアル酸の分布と機能
- 1 糖脂質
- 2 ムチン型糖タンパク質(O-結合型糖タンパク質)
- 3 アスパラギン結合型糖タンパク質(N-結合型糖タンパク質)
- 文献
第2章 シアル酸の分布と機能
シアル酸は生体内で、単体のほか、複合糖質の構成成分として、細胞膜表面のオリゴ糖の末端に存在して、重要な生物学的機能をもっている。1)生命現象の基本的な言語の第一は“核酸”、第二に“タンパク質”であることは当然であるが、第三の言語は“シアル酸誘導体”で、第四の言語は脂質である。Mr. SIALIC ACIDSの尊称をもらったシャウアー教授の定年退職記念講演で述べた言葉である。2)また、シアル酸のもつ水酸基がアセチル化されると、生体のガン化が進行することなどが明らかになりつつある。3)細胞膜表面糖鎖の中で最も重要なものは、糖脂質と糖蛋白質でいずれもシアル酸を含むものが多い。ここでは、この二つに分けて話してみよう。
1 糖脂質
糖脂質は、セラミドと呼ばれる長い炭化水素鎖をもつ複合糖質である。最もポピュラーな赤血球と脳について述べてみよう。ヒトの赤血球膜では、全脂質の約5%が糖脂質で、そのまた約5%が糖鎖の末端にN-アセチルノイラミン酸(17)をもっている。表-13にヒトの赤血球膜中に見いだされる糖脂質を多い順に示してある。4)
| 順位 | 糖脂質の構造 | (mg) |
| 1 | アセチルガラクトサミン−ガラクトース−ガラクトース−グルコース−セラミド | 9,600 |
| 2 | ガラクトース−グルコース−セラミド | 2,211 |
| 3 | ガラクトース−ガラクトース−グルコース−セラミド | 1,021 |
| 4 | ガラクトース−アセチルガラクトサミン−ガラクトース−グルコース−セラミド | 553 |
| 5 | N-アセチルノイラミン酸−ガラクトース−アセチルガラクトサミン−ガラクトース−グルコース−セラミド(GM1a) | 426 |
| 6 | N-アセチルノイラミン酸−ガラクトース−グルコース−セラミド(GM3) | 355 |
| 7 | グルコース−セラミド | 279 |
赤血球膜の糖脂質(表-13順位5、6)の糖鎖の末端にあるN-アセチルノイラミン酸(17)がはずれると、その赤血球は老廃物として肝臓で分解されて捨てられる運命にある。すなわち、赤血球の老化(エージング)をコントロールしているものと考えてよい。また、受精の際に一匹の精子が卵子に進入すると、シアリダーゼが分泌されて総ての精子のしっぽ(N-アセチルノイラミン酸)が切断され、他の精子は異物として排除されることもよく知られている。シアル酸の生理作用が如何に能率的であるかが分かるであろう。
| 番号 | 名称 | R1 | R2 | 参考 |
| 32 | GM1 | H | H | コレラ菌毒素の受容体 |
| 33 | GD1a | Neu5Acα2→3 | H | 細胞伸張、ヒト神経細胞伸張(Neuro2a) |
| 34 | GD1b | H | Neu5Acα2→8 | ボツリヌス菌毒素の受容体 |
| 35 | GT1b | Neu5Acα2→3 | Neu5Acα2→8 | 顕著な神経細胞伸張、ヒト神経細胞伸張(Neuro2a) |
| 36 | GQ1b | Neu5Acα2→8 | Neu5Acα2→8 | |
| Neu5Acα2→3 |
ヒトの脳や神経に大量にあるガングリオシドも糖脂質の重要なものである。脳や神経の研究者が脳や神経から得られた糖脂質でセラミドをもつものに、神経節の意味をとって、ガングリオシドと名付けた。ヒトの脳ガングリオシドは現在約60種が知られているが、その生理作用のすべてが明らかになったわけではない。一般的には、ガングリオシドは中性糖のほかに、アミノ糖とシアル酸を含むスフィンゴグリコリピドで、脳のほか神経細胞その他の組織細胞中に含まれ、基本的には、細胞の相互認識、増殖、分化、ガン化を司るほか、免疫やホルモン、フィブロネクチンの受容体などの生体機能を支配している。
ガングリオシドは各種の毒素の受容体にもなって、GM1はコレラ菌毒素の受容体であり、GT1bは辛子蓮根事件で記憶も遠くなったが、ボツリヌス菌毒素の受容体である。5)(図-14)また、シアリルラクトースとヘマグルチニンとの複合体のX線解析から明らかにされた結果、6)ウイルスの感染部位も明確になっている。また、ガングリオシドは核酸のリン酸化やカルシウムイオンの移動に関わっている。
特に面白い作用は、永井教授(東京大学名誉教授;三菱化学生命科学研究所名誉所長)らによって発見されたGQ1bの神経細胞の伸張、突起増加の作用である。7)この作用は弱いけれどもGD1aにも見られ、更に、ガングリオシド全般に神経伝達に関わる重要性が論ぜられている。例えば、GM3の直接脳内投与実験では、記憶力が増進し、アルツハイマー症に有効であるとの報告がある。8)記憶とガングリオシドの関係は今後、ますます重要な研究テーマとなってきた。
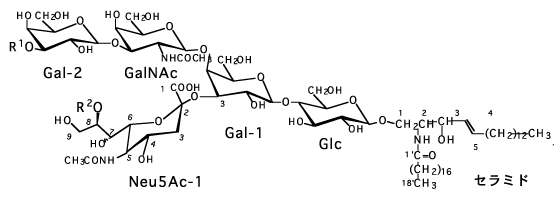
最近では、免疫細胞の認識機構が解明されて、細胞表面の糖鎖が重要な役割を演じていることが明らかになってきた。各種の免疫反応にモノクローナル抗体が利用されている。例えば、CA19-9は図-15に見られる構造の糖脂質(37)を認識するモノクローナル抗体である。この構造のシアル酸がなくても、また、フコースがなくてもCA19-9は反応しなくなる。CA19-9は消化噐ガンや膵ガンのマーカーとして利用されている。正常者の反応率は0.4%といわれる。9)
2 ムチン型糖タンパク質(O-グリコシド型)
糖タンパク質も、糖脂質に負けず劣らずの重要な生理作用を営んでいる。大別して、糖タンパク質はO-グリコシド型とN-グリコシド型がある。前者はムチン類がその代表である。これに対して、糖がタンパク質のアスパラギン(Asn)のアミノ基に接続しているものが、N-グリコシド型(アスパラギン結合型)と呼ばれる。
ムチン型糖タンパク質(O-グリコシド型)は図-16に示すように、タンパク質のセリン(Ser)か、トレオニン(Thr)の水酸基に、糖の還元末端が接続するものである。ムチン型糖タンパク質はマンノースを含まず、比較的簡単な糖鎖で形成されてシアル酸を含む場合が多い。これは内臓の分泌物として、臓器の保護や血清や尿のウイルスや細菌の毒素の不活化作用がある。
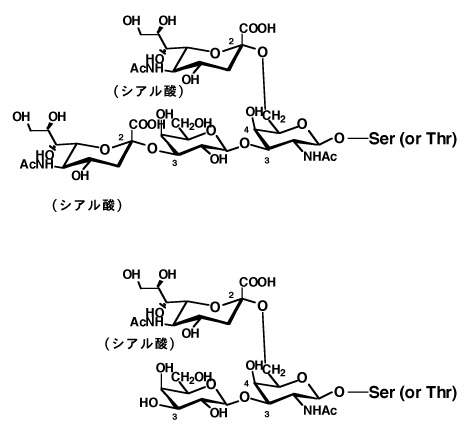
結合糖には、N-アセチルガラクトサミン、N-アセチルグルコサミン、キシロースなどがあり、末端にシアル酸をもつ。植物やカビ、酵母のムチン型糖鎖は、アラビノースやマンノースが結合糖となっていて、シアル酸を持たず、動物と大きく異なる。
ムチン型糖タンパク質の最大の生理作用は細胞表面の保護作用である。例えば、胃や腸の内壁は、強い酸や塩基と強力な消化酵素によって、簡単に分解されてしまうであろう。これを保護し、消化吸収を助けているのは、大変巧妙な構造と言える。その主役がムチン型糖タンパク質、特に末端に付着するシアル酸である。
細菌の大部分は、表面に糖鎖を認識するレクチンをもち、これがムチン型糖タンパク質に結合して細菌が感染する。胃や腸では、細菌などはムチンの中で繁殖して、体内に移行しないようになっている。また、グルコホリンやロイコシアリンのように血球の表面糖鎖に大量のシアル酸を含むものがある。例えば、グルコホリンAでは1個の赤血球に約5×105個が存在し、アミノ酸131個からなる糖タンパク質のセリンやトレオニンには15〜19個のムチン型糖鎖が結合している。10)グルコホリンの赤血球に占めるシアル酸量は80%にも及ぶ。また、ロイコシアリンは白血球にあって、その約85%のシアル酸量を持つものである。いずれも、多量のシアル酸量をもって細胞表面を保護すると共に、体内を移動する際に、異物と認識されないようになっている。ロイコシアリンはこれに反応するモノクロール抗体をT細胞に反応させると、細胞増殖や細胞接着をうながし、また、細胞の活性化を促進する。11)
3 アスパラギン型糖タンパク質(N-グリコシド型)
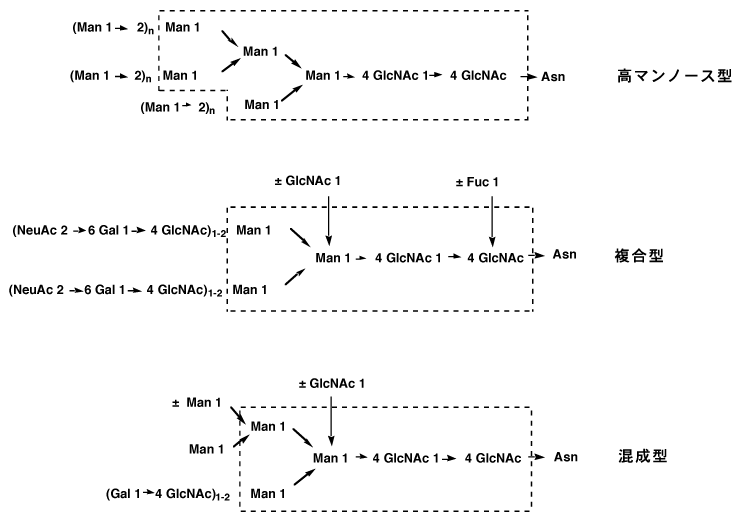
この糖タンパク質はすべてタンパク質のアスパラギンに結合している。アスパラギン結合型糖タンパク質はムチン型に較べて糖鎖が複雑であるが、構造上規則性があり、高マンノース型、複合型、混成型に分けられる。(図-17)
高マンノース型糖鎖では、点線で囲んだ7糖は共通であり、シアル酸を含まない。複合型糖鎖は高マンノース型糖鎖からマンノース2個引いた5糖からなる糖鎖が共通である。このグループの糖鎖は糖鎖の末端にシアル酸をもつ。複合型糖鎖と共通糖鎖は同じだが、シアル酸をもたない型が混成型と呼ばれる。12)これらのアスパラギン結合型糖タンパク質は複雑な生理作用をもち、酵素やホルモンなど多彩である。
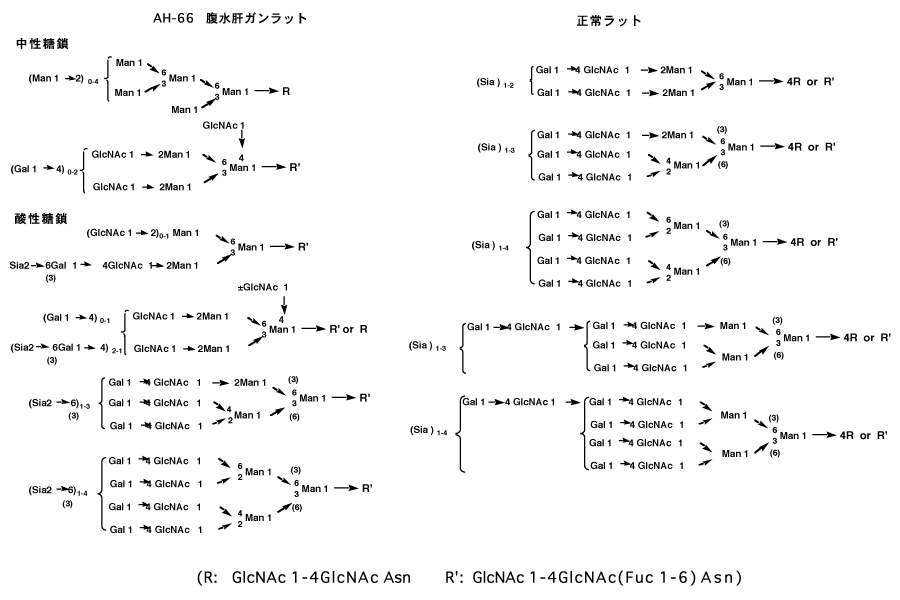
例えば、木幡教授(前東京都老人研究所所長)らの研究から明らかになった、γ-グルタミルトランスペプチダーゼや人絨毛性性腺刺激ホルモンの糖鎖構造などがある。複合型糖鎖からシアル酸を除去すると、生理活性がなくなることが分かっている。また、ガンが発生すると、関連するこれらの糖鎖構造が大きく変化する。一般にはシアル酸量が減少する。正常ラットの肝臓からえられるγ-グルタミルトランスペプチダーゼの糖鎖構造と、腹水肝ガンラットから精製したものとの比較を例示する。12)(図-18)ガン化すると、シアル酸結合糖鎖が減少して糖鎖構造全体も大きく変化しているのが分かる。このように、「ガン化するのは組織より先に、酵素系やホルモン系の複合糖鎖の変化から始まるのではないか」と考えられるから、この微小変化をコントロール出来ればガンの予防や転移の阻止が可能になる。13)このような考えで、シアル酸含有変型ヌクレオシドを合成した。14)
文献
- 1) T. -Y. Liu, W. Egan, J. B. Robbins, J. Infect. Dis. Suppl., 136, S71 (1977); W. Egan, T. -Y. Liu, D. Dorow, J. B. Cohen, J. B. Robbins, E. C. Gotschlich, J. B. Robbins, Biochemistry, 16, 3687 (1977); M. S. Bretscher, Scientific American, 253, 86 (1985); 木幡陽、箱守仙一郎、永井克孝編“糖鎖の多様な世界” ㈱講談社サイエンティフィク(1993).
- 2) R. Schauer, Zoology, 107, 49-64 (2004).
- 3) U. Hubl, H. Ishida, M. Kiso, A. Hasegawa, R. Schauer, J. Biochem., 127, 1021-1031 (2000); G. Kohla, E. Stockfleth, R. Schauer, Gangliosides with O-Acetylated Sialic Acids in Tumors of Neuroectodermal Origin, Neurochem. Res., 27, 583-592 (2002).
- 4) 山川民夫、“糖脂質物語”講談社、東京、1981年; R. Schauer Ed., “Silalic Acids, Chemistry, Metabolism, and Function,” Springer-Verlag, Wien, 1982.
- 5) 安藤進、化学と工業、37, 758 (1984).
- 6) E. W. Weis, J. H. Brown, S. Cusack, J. C. Paulson, J. J. Skehel, D. C. Wiley, Nature (London), 333, 426 (1988).
- 7) 辻崇一、永井克孝、化学と生物、22, 346 (1984).
- 8) L. Svennerholm, International Symposium on Glycoconjugate, Tokyo, March 10, 1993.
- 9) H. Koprowski, Z. Steplewski, K. Mitchell, M. Herlyn, D. Herlyn, J. P. Fuhrer, Somatic Cell Genetics, 5, 957 (1979); J. L. Magnani, B. Nilsson, M. Brockhaus, D. Zopf, Z. Steplewski, H. Koprowski, V. Ginsburg, J. Biol. Chem., 257, 14365 (1982); B. F. Atkinson, C. S. Ernst, M. Herlyn, Z. Steplewski, H. S. Sears, H. Koprowski, Cancer Res., 42, 4820 (1982).
- 10)M. Fukuda, Glycobiology, 1, 347 (1991); M. Fukuda, Seminars in Hematology, 30, 138 (1993).
- 11)Y. -H. Nong, E. Remold-O'Donnell, T. W. LeBien, H. G. Remold, J. Exp. Med., 170, 259 (1989); B. Ardman, M. A. Sikorski, D. E. Staunton, Proc. Nat. Acad. Sci. USA, 89, 5001 (1992).
- 12)木幡陽、薬学雑誌、104, 823 (1984); 木幡陽、第28回日本薬学会関東支部大会、要旨集、39 (1984);A. Kobata, A journey to the world of glycobiology, Glycoconjugate Journal, 17, 443-464 (2000).
- 13)小倉治夫、“複合糖質の化学” ㈱シーエムシー、東京、2000; 化学と生物、29, 248 (1991).
- 14)H. Ogura, “Carbohydrates-Synthetic Methods and Applications in Medicinal Chemistry”; Ed., H. Ogura, A. Hasegawa, T. Suami, Kodansha-VCH, 1992, 282; H. Ogura, K. Furuhata, M. Itoh, Y. Shitori, Carbohydr. Res., 158, 37 (1986); S. Sato, K. Furuhata, H. Ogura, Chem. Pharm. Bull., 36, 4678 (1988).